研究内容
分子シャペロンは、タンパク質の折りたたみ(folding)を制御するタンパク質です。タンパク質あるいはポリペプチドは、そのアミノ酸の配列順序で決まる立体構造に「自ら折りたたむ」わけですが、細胞の中は、生卵のようにどろっとするぐらいタンパク質濃度が高く、タンパク質が凝集しないで折りたたむのは困難です。そこで、その手助けをするタンパク質「シャペロン」が必要とされます。分子シャペロンは、折りたたみの途中にあるタンパク質や変性タンパク質などの凝集を抑え、機能をもつ(天然状態の)構造に折りたたむのを助けます。分子シャペロンは、ある基質が天然状態の構造になると、そのタンパク質から離れて、次の「クライアント」の折りたたみに関与します。このように、分子シャペロンは折りたたみ反応の触媒(酵素)であると言えます。
分子シャペロンはタンパク質の折りたたみ状態を制御して、タンパク質の(例えばミトコンドリアへの)膜透過、タンパク質の分解、シグナル伝達などにも関与しています。分子シャペロンはいくつかのファミリーに分けられ、代表的なものとして、small Hspあるいは低分子量Hsp(sHsp)、シャペロニンあるいはHsp60(GroEL)、Hsp70(DnaK)、Hsp90(HtpG)、Hsp104(ClpB)などが知られています。なお、( )内は、原核生物のメンバーの名称です。
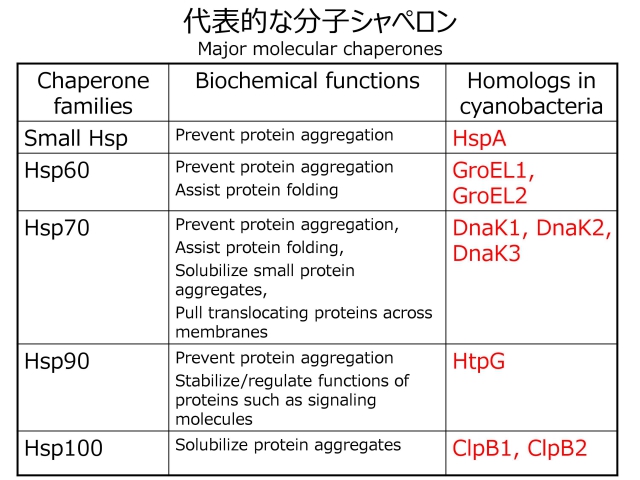
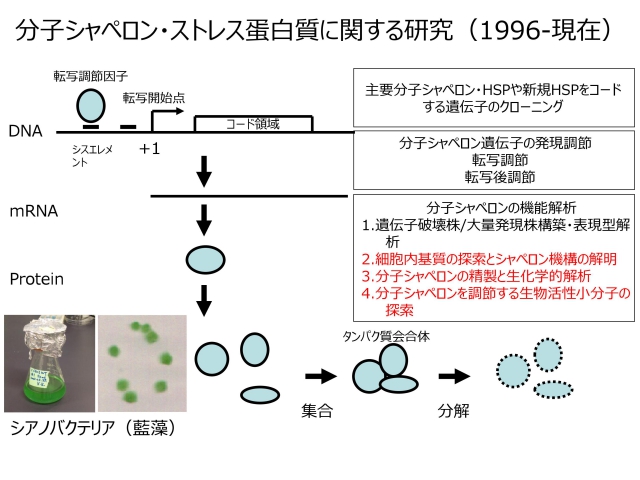
私たちは、シアノバクテリアを主たる実験材料にして、分子シャペロン遺伝子のクローニングから始めて、遺伝子発現調節、変異株の構築・表現型解析、遺伝子翻訳産物(分子シャペロン)の試験管レベルにおける機能解析へと、一歩一歩研究を進めてきました(下図)。「埼玉(大学)産の」研究成果を、国内外の研究者との共同研究を通して、さらに発展させたいと考えています。
関連する書籍
- Huq, S. and H. Nakamoto
- Heat shock proteins and acquisition of thermotolerance in plants.
- In: M. Pessarakli, ed., Handbook of Plant and Crop Stress. 3rd ed. Chapter 20: pp. 519-534. CRC Press. 2010.
- H. Nakamoto
- Molecular chaperons and stress tolerance in cyanobacteria.
- In: Srivastava, A.K., A.N. Rai and B.A. Neilan, eds., Stress Biology of Cyanobacteria:
- Molecular Mechanisms to Cellular Responses. pp. 113-144. CRC Press. 2013.
研究内容(研究の一部)を、以下の順序で説明します。
- Hsp90(HtpG)
- small Hspあるいは低分子量Hsp(sHsp)
- シャペロニンあるいはHsp60(GroEL)
- その他の分子シャペロンやHspに関する研究
- シアノバクテリアの分子シャペロン(HSP)遺伝子の発現調節
- 分子シャペロンによる生体膜品質管理
1. Hsp90 (HtpG)
1.1 原核生物Hsp90のシャペロン作用メカニズムの解明
一般的に、分子シャペロンは、他の分子シャペロンやコシャペロン(補助因子)と相互作用をして、協同で働きます(協調的にシャペロン作用します)。ヒトなどの真核細胞では総タンパク質の~2%を占める最も豊富な分子シャペロンであるHsp90は、多様なコシャペロンやシャペロンと相互作用し、細胞の増殖や生存に関わる200種類以上の基質タンパク質(クライアント)の構造を安定化し、その折りたたみを制御しています。分子シャペロンは細胞のタンパク質の恒常性(proteostasis)を維持するために緩衝剤のような働きをしますが、Hsp90は、(驚くべきことに)緩衝剤としてゲノムにおける遺伝子変異の蓄積をゆるし、生物進化やがん細胞の増殖に貢献していると考えられています。
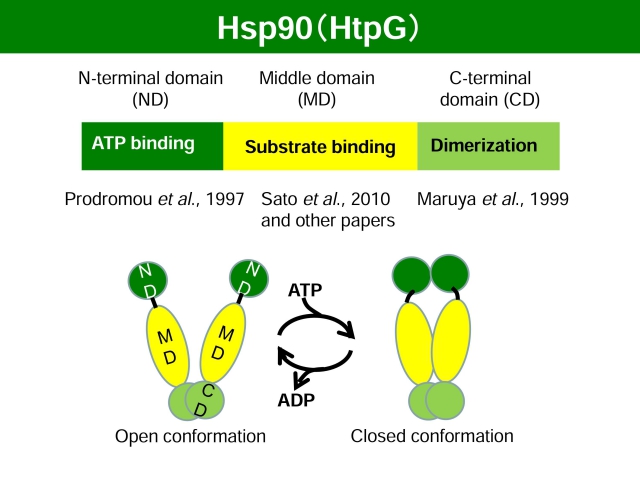
Hsp90のシャペロン機能は、ATPとの結合とその加水分解を介した立体構造の変化により制御されています。Hsp90は、三つの主要ドメイン(N末端ドメイン、中間ドメイン、C末端ドメイン)から成ります。C末端ドメインを介して恒常的にホモ二量体を形成していますが、N末端ドメインのATP結合ポケットにATPが結合するとN末端ドメインどうしが一過的に結合します(http://pdbj.org/#!mom/108)。これにより、中間ドメインの構造変化も誘発されて、Hsp90はATPを加水分解するようになります。Hsp90に結合したクライアントタンパク質は、ATPの結合と加水分解に伴って起こるHsp90の構造変化に伴って、その構造も変化すると考えられますが、よくわかっていません。
真核生物のHsp90は生存に必須のタンパク質で、上述のようにクライアントやコシャペロンも明らかにされ、広範囲にわたる細胞機能においてHsp90の重要性が明らかにされています。対照的に、大腸菌や枯草菌などでは平常時のみならず高温下でもHsp90(HtpG)は(高温耐性に)必須ではなく、その機能は不明でした。私たちは、シアノバクテリアSynechococcus elongatus PCC7942株のhtpG遺伝子をクローニングし、その遺伝子破壊株を作製し、Hsp90あるいはHtpGが高温における生育・生存に必須の働きをする(変異株の致死温度における生存率は、野生株に比べて1/1000以下に低下する!)ことを初めて明らかにしました。さらに、HtpGが細胞の低温順化や強光・酸化ストレスに対する耐性の獲得においても重要な働きをすることを初めて報告しました。
分子シャペロンは酵素の一つと見做せるのではないかと書きましたが、ある酵素を理解するには、基質、生成物や補因子が何かは当然のことですが、さらに基質特異性や反応特異性、活性調節機構などを明らかにすることが重要です。上に述べたように、真核細胞Hsp90のクライアント(基質)やコシャペロン(補助因子)は多数明らかにされていて、コシャペロンがHsp90の基質特異性やシャペロン活性の調節など、そのシャペロン機能にとって必須の働きをすることが明らかにされています。後で述べるように、薬の開発等のために多くの阻害剤も発見(あるいは合成)され、研究されてきました。一方、原核生物のHsp90(HtpG)のコシャペロンは全く明らかにされていません。クライアントが何であるか、他の分子シャペロンと相互作用(協調的シャペロン作用)をするのかどうかも明らかにされていませんでしたが、私たちは以下のように、それらを世界に先駆けて明らかにしてきました。
- (1)
- 原核生物(シアノバクテリア)Hsp90のタンパク質基質を初めて同定しました。これらの基質は既に報告されている真核細胞のものとは異なっていました。
- (2)
- Hsp90の主要な基質結合ドメインを明らかにしました。
- (3)
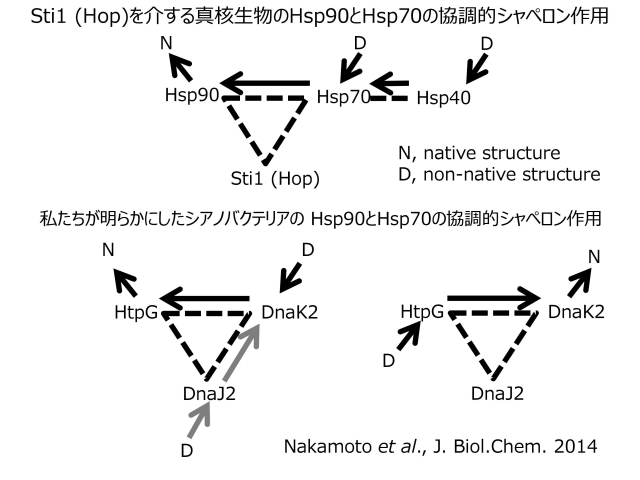
- 原核生物Hsp90はHsp70(DnaK)と協調的にシャペロン作用することを明らかにしました。真核生物では、Hsp90がHsp70と相互作用して協調的にシャペロン作用をするには、これらに結合するコシャペロン(Hop/Sti1)が必要になりますが、原核生物の場合はこのようなコシャペロンがなくても、二つの分子シャペロンが直接相互作用することがわかりました。詳細は、以下の4.1(DnaK2/DnaJ2/GrpEシャペロン系とHtpG/DnaK2/DnaJ2/GrpEシャペロン系)をご参照ください。
代表的な発表論文
- Tanaka N, Nakamoto H. FEBS Lett. 458:117-123, 1999.

- Hossain MM, Nakamoto H. Curr Microbiol. 46:70-76, 2003.

- Watanabe S, Kobayashi T, Saito M, Sato M, Nimura-Matsune K, Chibazakura T, Taketani S, Nakamoto H,
Yoshikawa H. Biochem Biophys Res Commun. 352:36-41, 2007.
- Sato T, Minagawa S, Kojima E, Okamoto N, Nakamoto H. Mol Microbiol. 76:576-589, 2010.

- Nakamoto H, Fujita K, Ohtaki A, Watanabe S, Narumi S, Maruyama T, Suenaga E, Misono TS, Kumar PK,
Goloubinoff P, Yoshikawa H. J Biol Chem. 289:6110-6119, 2014.
1.2 Hsp90の機能を調節する小分子化合物(阻害剤や活性化剤)の探索と調節メカニズムの解明
真核細胞のHsp90は、がん細胞の増殖や生存にかかわるさまざまな変異タンパク質,過剰発現タンパク質,キメラタンパク質の安定性および活性に必要不可欠であるために、がん細胞のHsp90への依存度は正常細胞よりも高いことが知られています。がん細胞はHsp90「依存症」になっている(addict)と言えます。そのためにHsp90は抗がん薬の有望な分子標的となり、多数のHsp90阻害剤が見出され(合成され)、抗がん活性の臨床試験も行われています。しかしながら、これらの阻害剤は、未だ「薬」として用いられるには至っていません。
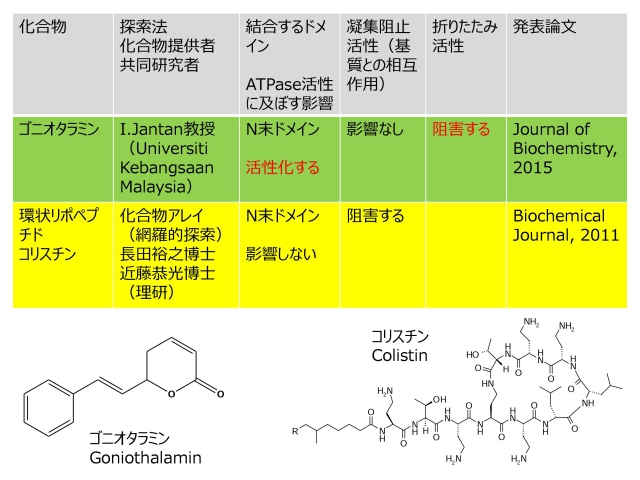
私たちは、Hsp90と特異的に結合し、そのシャペロン活性やATPase活性を阻害、あるいは活性化する小分子化合物を探索し、これらの化合物の阻害・活性化機構を解析してきました。これまでに、環状リポペプチド抗生物質コリスチンが、Hsp90のN末端ドメインに特異的に結合し、「ATPase活性には影響せず」に、分子シャペロン活性を阻害することを明らかにしました(理化学研究所長田研究室との共同研究)。最近では、アリスロファクチンやサーファクチンなどの環状リポペプチドとHsp90の相互作用も解析し興味深い結果を得ています(北海道大学理学部森川正章教授との共同研究)。また、東南アジアなど熱帯・亜熱帯地域に自生する植物から抽出された天然化合物の中で抗がん活性を示すものが、Hsp90と相互作用し、そのATPase活性を「活性化」することを発見しました(Universiti Kebangsaan Malaysia薬学部 Ibrahim Jantan教授との共同研究)。Hsp90を標的とした抗がん剤の研究は、ATPase活性の阻害剤のみに集中して行われてきましたが、活性化によってHsp90のシャペロン機能を「阻害する」という新規なアプローチを確立することにより、創薬研究の新展開を導くことができるのではないかと考えています。
代表的な発表論文
- Minagawa S, Kondoh Y, Sueoka K, Osada H, Nakamoto H. Biochem J. 435:237-246, 2011.

- Miyata Y, Nakamoto H, Neckers L. Curr Pharm Des. 19:347-365, 2013. 総説

- Yokoyama Y, Ohtaki A, Jantan I, Yohda M, Nakamoto H. J Biochem. 157:161-168, 2015.

2. small Hspあるいは低分子量Hsp(sHsp)
sHsp は、真正細菌、古細菌及び真核生物のどのドメインの生物にも存在する普遍的な分子シャペロンです。「低分子量」Hspと呼ばれるのは、種々のsHspのモノマーの分子量は12 K から42 K の比較的「低分子量」の範囲にあるためですが,2量体を単位にして大きなオリゴマーを形成し、sHspのオリゴマーには32量体を超えるものもあります。実は、その名とは対照的に巨大な分子なのです。モノマーのサイズもオリゴマーのサイズも多様ですが、アミノ酸配列も、HSP90、HSP70 やHSP60 などと比較すると、あまり保存されていません。しかしながら、どのsHspも(~100アミノ酸から成る)α-クリスタリンドメインと呼ばれるβ-sandwich構造をもちます。他の分子シャペロンと異なりsHspはATPase活性を示しませんが、sHspは変性タンパク質と結合して凝集塊形成を阻害します。Hsp70(DnaK)などの他の分子シャペロンが存在すると、sHspに結合した変性タンパク質は機能的な天然の構造に再生します。従って、sHspは変性タンパク質の凝集を抑えて再生可能な状態に維持(保持)すると考えられています。sHspは、眼の水晶体の主成分で、その透明性を維持しています。sHspの変異は、筋肉の疾患や神経障害などの病気にも関係していることが分かっています。
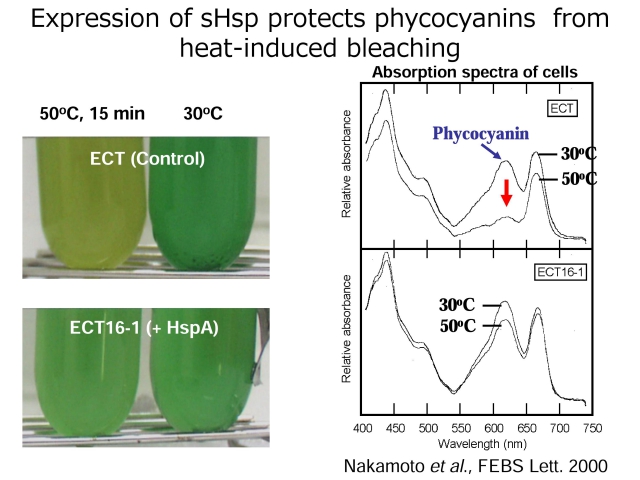
私たちは、好熱性シアノバクテリア(Synechococcus vulcanus)から初めて、熱ショックで迅速に誘導されるsHsp遺伝子(hspA)をクローニングしました。生化学的解析によって、このsHspがホモ24 量体を形成することや、他のタンパク質の熱による変性凝集を抑制することも明らかにしました。sHspを構成的に大量発現するシアノバクテリア変異株を構築したところ、この株の熱耐性(致死温度における生存率は10倍以上!)、光合成電子伝達活性、光合成の集光機能を担うフィコシアニンの熱安定性が顕著に増加しました(下図)。これらの結果は、高温ストレス下で,sHspが独立栄養生物の光合成機能をまもるという重要な役割を果たしていることを示唆するものです。光合成電子伝達系やフィコシアニンを主成分とするフィコビリソーム複合体はチラコイド膜に存在しますが、私たちはsHspがサイトゾルに加えてチラコイド膜にも存在すること、さらにsHspは、変性条件下でフィコシアニンと直接相互作用して凝集を阻止し、その集光機能を保つことを明らかにしました。sHspは高温ストレスのみならず、塩ストレスや(過酸化水素やメチルビオローゲン存在下における)酸化ストレスに対する耐性の獲得にも重要な働きをすることを明らかにしました。
代表的な発表論文
- Roy SK, Nakamoto H. J Bacteriol. 180:3997-4001, 1998.

- Roy SK, Hiyama T, Nakamoto H. Eur J Biochem. 262:406-416, 1999.

- Nakamoto H, Suzuki N, Roy SK. FEBS Lett. 483:169-174, 2000.

- Nitta K, Suzuki N, Honma D, Kaneko Y, Nakamoto H. FEBS Lett. 579:1235-1242, 2005.

- Nakamoto H, Honma D. FEBS Lett. 580:3029-3034, 2006.

- Nakamoto H, Vígh L. Cell Mol Life Sci. 64:294-306, 2007. 総説

- Sakthivel K, Watanabe T, Nakamoto H. Arch Microbiol. 191:319-328, 2009.

3. シャペロニンあるいはHsp60(GroEL)
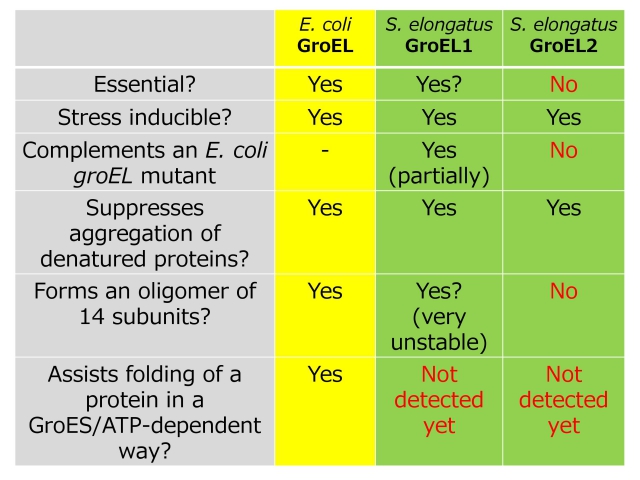
生物界に普遍的に存在し、生存に必須の働きをする分子シャペロンです。真正細菌(バクテリア)のシャペロニンはGroELと呼ばれます。大腸菌のGroELは、その構造や機能が最も明らかにされている分子シャペロンです。生化学の教科書でも詳しく説明されていますので、ここでは簡単に述べておきます。大腸菌GroEL は,14 個のGroEL(サブユニット)が集まって(14 量体を形成して),筒(かご)状の構造を形成します。その上に、GroES(コシャペロン)が7個集まって形成された「ふた」が結合します。このGroES-GroEL複合体の内部の空洞の中に、完全に折りたたまれていないポリペプチドや変性ポリペプチドが1個入ると,細胞内の他のタンパク質と相互作用をすることなく,それは天然の構造に折りたたみます。上に述べましたが、細胞の中は高濃度のタンパク質溶液で、凝集しやすい環境にあるわけですが、ポリペプチドが1個ずつ隔離されると凝集のおそれはありません。GroELがシャペロン機能を果たす上で,このような構造は非常に重要なので、大腸菌のGroEL は安定な14 量体を形成します。
私たちは、大腸菌や枯草菌とは異なり,シアノバクテリアには二種類のgroEL 遺伝子が存在し,一方はgroES とオペロンを形成するのに対して,他方はしないことを明らかにして(同時期に他のグループが発見したので、2番目に報告しました)、前者をgroEL1,後者をgroEL2 と命名しました。多くのバクテリアのゲノム解析が進み、シアノバクテリア以外にも複数種のgroEL遺伝子をもつものがあることが分かってきました。それでは、なぜ複数種のGroEL が存在するのでしょうか。私たちは、二種類のGroELの発現調節や機能が異なるのではないかと仮定し、それを明らかにするためにin vivoとin vitroの両側面から研究を進めてきました。以下の表に今までの成果の一部を纏めましたが、私はGroEL1は大腸菌型で、GroEL2は14量体を形成しない新規なGroELと考えています。GroEL1は、大腸菌でも等しく重要な、生存にとって必須な機能を担うのに対して、GroEL2は、シアノバクテリアのみで重要な機能を果たしているのではないかと考えています。シアノバクテリアは、温度、光強度、栄養条件などの変化の激しい環境で生息しているので、環境変化(ストレス)に対する高い順化・適応能力が必要とされます。そのために、GroEL2がシアノバクテリアの進化の中で現れたのではないかと考えています。実際Thermosynechococcus elongatusのgroEL2 遺伝子破壊株は,野生株が生育しうる高温下や低温下で,(GroEL1 が存在するにもかかわらず)全く生育できませんでした。常温性シアノバクテリアのgroEL2 遺伝子破壊株も高温や強光等のストレスに対して感受性であったので、GroEL2は種々のシアノバクテリアの環境ストレス応答において重要な役割を果たしていると考えています。
代表的な発表論文
- Furuki M, Tanaka N, Hiyama T, Nakamoto H. Biochim Biophys Acta. 1294:106-110, 1996.

- Tanaka N, Hiyama T, Nakamoto H. Biochim Biophys Acta. 1343:335-348, 1997.

- Sato S, Ikeuchi M, Nakamoto H. FEBS Lett. 582:3389-3395, 2008.

- Huq S, Sueoka K, Narumi S, Arisaka F, Nakamoto H. Biosci Biotechnol Biochem. 74:2273-2280, 2010.

4. その他の分子シャペロンやHspに関する研究
4.1 DnaK2/DnaJ2/GrpEシャペロン系と新規HtpG/DnaK2/DnaJ2/GrpEシャペロン系
私たちは、Synechococcus elongatus PCC7942株のHtpGとDnaJ2(Hsp40)、HtpGとDnaK2、DnaJ2とDnaK2が相互作用し複合体を形成することを酵母ツーハイブリッド法やプルダウン法等で初めて明らかにしました。DnaJ2やDnaK2は、シアノバクテリアに複数存在するDnaJやDnaKホモログの一つで、HtpGと同様に高温などのストレスで誘導されます。このような物理的な相互作用は、HtpGがDnaK2やDnaJ2と協同でシャペロン作用することを示唆するものですが、これを明らかにするために、私たちはまずシアノバクテリアのDnaK2/DnaJ2/GrpEシャペロン系を確立しました。大腸菌等ではDnaKと、DnaJやGrpEのコシャペロンが協同で、シャペロン作用することは明らかにされていましたが、シアノバクテリアではほとんど研究されていませんでした。DnaK2は、コシャペロンであるDnaJ2とATPに依存して、熱変性したリンゴ酸脱水素酵素や尿素変性した乳酸脱水素酵素の再折りたたみ(refolding)を介助し、GrpE(ヌクレオチド交換因子)がこのシャペロン活性を増大させることを明らかにしました。さらに、HtpGは、このDnaK2/DnaJ2/GrpEシャペロン系と協調的にシャペロン作用することを初めて明らかにしました(HtpG/DnaK2/DnaJ2/GrpEシャペロン系の確立)。このようなHtpGが関与するシャペロンネットワークの発見は、原核生物Hsp90(HtpG)の作用機構解明に向けた第一歩となりました。
代表的な発表論文
- Nakamoto H, Fujita K, Ohtaki A, Watanabe S, Narumi S, Maruyama T, Suenaga E, Misono TS, Kumar PK,
Goloubinoff P, Yoshikawa H. J Biol Chem. 289:6110-6119, 2014.
4.2 シアノバクテリアのClpB(新規なClpBホモログClpB2)
分子シャペロンClpB(Hsp104)は、上記のどの分子シャペロンとも異なり、変性タンパク質の凝集を阻止する機能も折りたたみ活性ももちませんが、DnaK/DnaJ/GrpEシャペロン系と協調して凝集塊を可溶化する(という驚くべき機能をもつ)と報告されています。この脱凝集活性はClpB(Hsp104)特有の機能であり、致死的な高温における細胞の熱耐性に必須であることが明らかにされています。モデル生物である大腸菌や酵母には、ClpB(Hsp104)は1種類しか存在しないのに対し、Synechococcus elongatus PCC7942株を含む多くのシアノバクテリアには2種類のClpB(ClpB1及びClpB2)が存在します。大腸菌ClpBやシアノバクテリアのClpB1は熱ショックで発現が誘導されるのに対して、ClpB2は、恒常的に発現し、通常の生育に必須であるという特性を示しますが、ClpB2の生化学的解析は行われていません。私たちは、ClpB1とClpB2の比較生化学的解析を行い、ClpB2の性質がClpB1(や大腸菌ClpB)とは顕著に異なることを明らかにしました。
4.3 私たちが初めて発見した新規なHsp(Orf7.5)
熱ショックで誘導される、63個のアミノ酸から成るポリペプチドをコードする新規なHsp(Orf7.5)遺伝子をクローニングしました。この遺伝子破壊株は顕著な高温感受性を示すので、Orf7.5は高温下で重要な働きをすることが明らかになりました。この変異株のgroESL1オペロンの発現量が極端に減少していたので、Orf7.5はGroEL1などの分子シャペロンの発現調節に関与するのではないかと考えています。
発表論文
4.4 isiABCオペロン
光合成装置を構成するCP43'やフラボドキシンをコードするisiABCオペロンが鉄欠乏下のみならず酸化及び熱ストレス下でも必須の働きをするストレスタンパク質であることを初めて明らかにしました。
発表論文
5. シアノバクテリアの分子シャペロン(HSP)遺伝子の発現調節
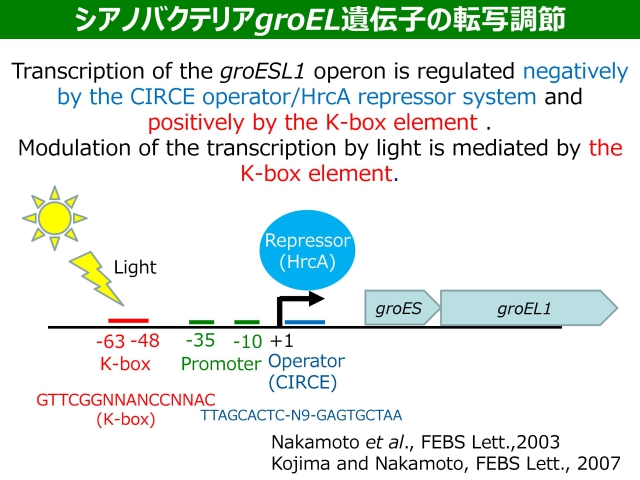
細胞が熱ショックをうけると、変性タンパク質の凝集を防ぎ、変性タンパク質を再生するために、分子シャペロンは,(熱ショックタンパク質Hspとして)一過的に高発現します。この発現は、どのようにして誘導されるのでしょうか。モデル生物である大腸菌では、Hsp遺伝子の転写に特異的に必要とされるシグマ因子(σ32)が熱ショックにより一時的に増加(安定化)し,その結果このシグマ因子と結合したRNAポリメラーゼ(ホロ酵素)が増加するので、Hsp遺伝子の転写が誘導されます。このような「正」の調節に対して,通常温度におけるHsp遺伝子の転写がリプレッサー(HrcAなど)で抑制される(熱ショックではこの抑制が解除される)という「負」の機構が枯草菌などで明らかにされました。私たちがシアノバクテリアから初めてクローニングした低分子量Hsp(hspA)遺伝子やgroEL遺伝子の転写開始点上流には(通常の生育に必要とされる多くの遺伝子の転写に関わる)主要シグマ因子に認識されるプロモーター配列が存在することから、これらの遺伝子の熱ショック誘導は「負」に調節されているのではないかと仮定しました。
私たちは、シアノバクテリアのhrcA遺伝子破壊株を構築し、groEL遺伝子は「負」(CIRCE/HrcA抑制機構)の調節を受けることを明らかにしました。ただし、枯草菌とは異なり、光(光合成電子伝達系)を介した、新規な「正」の調節も関与することを示し、その調節配列であるK-boxやN-boxを明らかにしました。
シアノバクテリアのhspA遺伝子は、次のような転写後調節も受けることを明らかにしました。即ち、この遺伝子のmRNAのリボソーム結合領域の二次構造が温度で変化し,リボソームが(高温で)結合できるようになり翻訳が開始されるというメカニズムが存在することを示しました。
代表的な発表論文
- Nakamoto H, Suzuki M, Kojima K. FEBS Lett. 549:57-62, 2003.

- Kojima K, Nakamoto H. Biochem Biophys Res Commun. 331:583-588, 2005.

- Kojima K, Nakamoto H. FEBS Lett. 581:1871-1880, 2007.

6. 分子シャペロンによる生体膜品質管理
ほとんどの分子シャペロンは可溶性で、膜タンパク質のような疎水性タンパク質ではありませんが、分子シャペロンが生体膜に結合しているという多数の報告があります。その一つの例が、上に述べたsHspで、シアノバクテリアでも高等植物でも、サイトゾルのみならずチラコイド膜にも局在しています。一般的に、分子シャペロンはタンパク質の品質管理に関与すると考えられていますが、分子シャペロンは生体膜の品質管理にも関与するのではないかという仮説をたてて、この仮説を分子レベルで明らかにし、パラダイムシフトを目指すことを目的にして研究を進めています。なお、この研究は日本学術振興会の二国間(日本・ハンガリー)交流事業プロジェクトとして、ハンガリー科学アカデミーBiological Research CentreのLászló Vigh博士らと共同で進めてきました。
代表的な発表論文
- Nakamoto H, Vígh L. Cell Mol Life Sci. 64:294-306, 2007.

- Vigh L, Nakamoto H, Landry J, Gomez-Munoz A, Harwood JL, Horvath I. Ann N Y Acad Sci. 1113:40-51, 2007.

- Horváth I, Glatz A, Nakamoto H, Miskind ML, Munnik T, Saidi Y, Goloubinoff P, Vigh L. Prog Lipid Res. 51:208-220, 2012.

