研究内容
多糖類合成の制御
「植物の糖ヌクレオチド合成経路の同定・改良」
光合成で同化された炭素の大半は、糖ヌクレオチドを経て、植物の細胞壁の多糖類として蓄積します(図1)。糖ヌクレオチドはその名の通り、グルコースなどの単糖とUDPなどのヌクレオチドが結合した物質です(図2)。従いまして、糖ヌクレオチドの合成量は同化炭素の多糖類への変換に影響します。
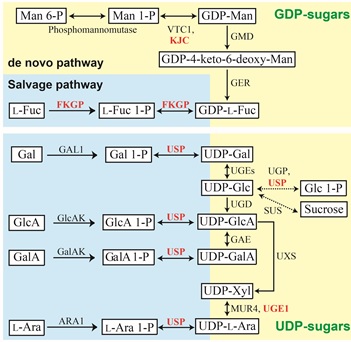
糖ヌクレオチドの合成経路にはde novo経路(新生経路)とsalvage経路(再利用経路)の2種類があり、新生経路では、UDP-Glcを初発基質とした変換反応により様々なUDP-糖が合成されます。一方、再利用経路では多糖類の分解などで生じた単糖が単糖1-リン酸を経て糖ヌクレオチドに変換されます(図3)。これまで、特に再利用経路の最終反応 (糖1-リン酸の糖ヌクレオチドへの変換) を触媒する酵素が見つかっていませんでした。
最近、私たちはエンドウ芽生え (トウミョウ) 中に新規のUDP-糖ピロフォスフォリラーゼ、USPを見いだし、生化学的に精製するとともに、遺伝子を単離することに成功しました。USPは糖 1-リン酸に幅広い基質特異性を持った酵素で、様々な糖1-リン酸をUDP-Glc, UDP-Gal, UDP-GlcA, UDP-Xyl, UDP-L-Ara に変換する活性を持っています。大腸菌で作成した組換えPsUSPタンパク質も同様の活性を持っていました。この酵素は新種の酵素だったので、国際生化学・分子生物学連合の酵素命名委員会に報告し、酵素番号(EC 2.7.7.64)が付与されました。
他にも、L-フコースをGDP-L-フコースに再生するFKGPや、細胞質基質でUDP-L-アラビノースを合成するUGE1、GDP-マンノース合成に関わるKONJACタンパク質を発見・同定しました(図3中で赤字の酵素)。現在は、糖ヌクレオチド合成酵素の起源を調べることで、植物特有の糖がいつ獲得され、植物にとってどんな意味があったのかを調べる研究を進めています。また、糖ヌクレオチドの代謝経路を改良することで、私たちにとって有用な多糖類を蓄積する植物の開発にも取り組んでいます。
参考文献
- Kotake et al. (2016) J. Plant Res. 424, 169-177 (abstract)
- Sawake et al. (2015) Plant Cell 27, 3397-3409(abstract)
- Kotake et al. (2009) Biochem. J. 129, 781-792(abstract)
- Kotake et al. (2008) J. Biol. Chem. 283, 8125-8135(abstract)
- Kotake et al. (2007) Biosci. Biotechnol. Biochem. 71, 761-771 (abstract)
- Kotake et al. (2004) J. Biol. Chem. 279, 45728-45736(abstract) 09
新種酵素の探索・同定
「アラビノガラクタン-プロテインの糖鎖を分解する酵素」
多糖類を分解する酵素には180種類ほどが知られていますが、そのうちの3種類は、私たちが発見したアラビノガラクタン-プロテイン (AGP) の糖鎖の分解酵素です。
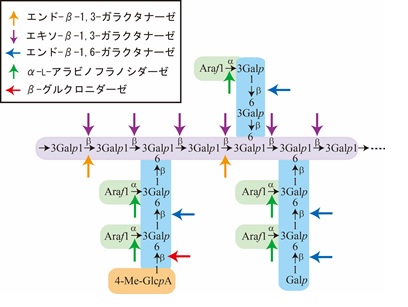
AGPは高等植物の原形質膜や細胞壁に存在する、植物のプロテオグリカンです(図4はAGPをGFPで可視化した写真)。AGPは細胞分裂、細胞生長、細胞接着、細胞死などに関わることが明らかになって いますが、その分子機能はわかっていません。AGPはガラクトースとアラビノースに富んだ糖鎖とヒドロキシプロリンに富んだコアタンパク質から構成され、 糖鎖は重量の90%以上を占めています。AGP糖鎖の構造はその由来により異なりますが、共通してβ-3,6-ガラクタン骨格を持っていて、さらに1,6-ガラクタンに、アラビノース、グルクロン酸、4-メチルグルクロン酸、フコースなどが結合しています(図5)。植物の体内には、コアタンパク質が異なる多数の AGP分子種が存在しているため、変異体やアンチセンス導入個体を用いた機能解析はとても困難です。またヘテロで複雑な糖鎖が結合していることもAGPの 機能解析を難しくしています。
私たちは、AGP糖鎖が共通してβ-3,6-ガラクタン骨格を持っていることに着目して、AGP糖鎖の分解酵素の単離と性状解析を進めています。特異的 な分解酵素はAGPの糖鎖の構造を決定する上で非常に有効なツールとなるだけでなく、分解酵素遺伝子を植物に導入することでAGP糖鎖の機能を明らかにする可能性も秘めています。私たちはこれまでに、エキソ-β-1,3-ガラクタナーゼ (EC 3.2.1.145)、エンド-β-1,3-ガラクタナーゼ (EC 3.2.1.181)、エンド-β-1,6-ガラクタナーゼ(EC 3.2.1.164)を発見しました。また、β-ガラクトシダーゼ、α-L- アラビノフラノシダーゼ、β-L- アラビノピラノシダーゼ、β-グルクロニダーゼを同定しました (図5)。
現在は、カビやバクテリアからクローニングした分解酵素遺伝子を植物に遺伝子導入する研究も進めています(図6)。特異的な分解酵素でAGPの糖鎖だけを分解したときに植物がどのような形質を示すのかを調べています。
- Imaizumi et al. (2017) J. Exp. Bot. 68, 4651-4661 (abstract)
- Yoshimi et al. (2017) Carbohydr. Res. 453-454, 26-35 (abstract)
- Kitazawa et al. (2013) Plant Physiol. 161, 1117-1126 (abstract)
- Kotake et al. (2011) J. Biol. Chem. 286, 27848-27854(abstract)
- Konishi et al. (2008) Carbohydr. Res. 343, 1191-1201 (abstract)
- Ichinose et al. (2008) Appl. Environ. Microbiol. 74, 2379-2383 (abstract)
- Kotake et al. (2006) J. Exp. Bot. 57, 2353-2362(abstract)
- Kotake et al. (2005) Plant Physiol. 138, 1563-1576(abstract)
- Ichinose et al. (2005) J. Biol. Chem. 280, 25820-25829(abstract)
- Kotake et al. (2004) Biochem. J. 377, 749-755(abstract)
ポキポキ折れるイネ
「イネのカマイラズ変異体の原因遺伝子クローニングと解析」
細胞壁には、成長中の細胞にみられる一次細胞壁と、成長が終わった細胞で一次細胞壁の内側に肥厚する二次細胞壁の2種類があります。樹木の幹は大半が二次細胞壁でできています。また、イネやコムギの葉や茎も二次細胞壁を肥厚させて堅くなります。イネのカマイラズ変異体はその名(鎌要らず)のとおり、軽く折り曲げただけで割れたりちぎれてしまう、二次細胞壁が異常な突然変異体です(図7)。カマイラズは、イネだけでも、原因遺伝子の異なる10種類以上が知られていて、英語でbrittle culm(bc、脆い茎)1から15という名前がついています。
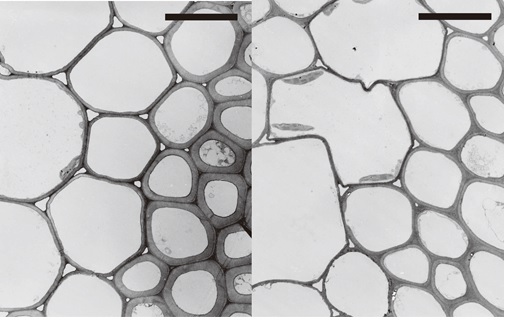
私たちは、このうちのbc3とbc6の原因遺伝子を突き止めることができました。多くのカマイラズでは、二次細胞壁の主成分であるセルロースがちゃんと合成できないために、普通のイネ(図8左)と比べて細胞壁が薄くなっています(図8右)。カマイラズの原因遺伝子は様々で、例えばbc6ではセルロース合成酵素に異常があり、bc3では細胞内の膜輸送に関わる因子に異常があります。カマイラズで見られる細胞壁の異常と原因遺伝子から、植物の二次細胞壁の合成メカニズムを明らかにしたいと考えています。
参考文献
- Kotake et al. (2011) J. Exp. Bot. 62, 2053-2062 (abstract)
- Hirano et al. (2008) Planta 232, 95-108 (abstract)
- Aohara et al. (2009) Plant Cell Physiol. 50, 1886-1897 (abstract)
氷と細胞壁の関係
「植物の凍結耐性を向上させる細胞壁の変化」
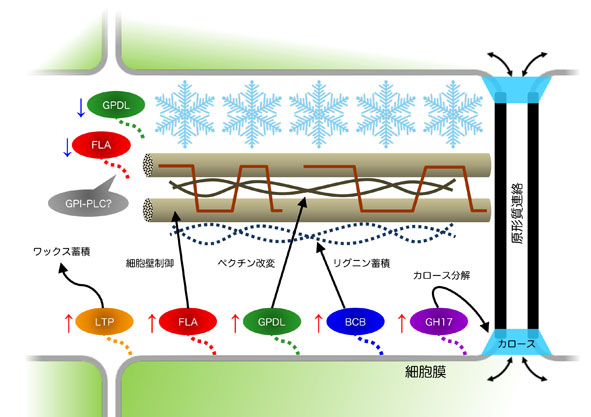
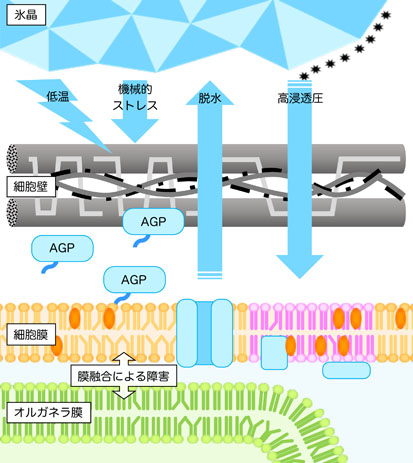
植物は光や温度など常に様々な環境の変化に適応しながら生きています。私たちはその中でも、植物と凍結ストレスの関係に興味を持って研究に取り組んでいます。植物が凍結温度に曝されると、細胞外空間(細胞壁)から氷の形成が始まり、細胞の脱水や細胞への機械的圧迫を伴って氷が伝播していきます(図9)。植物が凍結ストレスを生き抜くには細胞壁の性質が鍵の一つになると言えます。
植物は気温の低下を通じて厳しい冬の到来を感知し、凍結耐性を上昇させる機構を持っています(低温馴化、図10)。低温馴化の過程では凍結耐性の上昇とともに、可溶性糖の蓄積や細胞膜脂質組成の変化によって、組織の凍結温度を低下させ、膜の不可逆的傷害を防いでいることがわかっています。一方で、いくつかの植物の細胞壁においては、低温馴化によりペクチンの主要構成多糖であるホモガラクツロナンのカルシウム架橋が増加することが観察されています。しかし、現在までに細胞壁の変化が具体的にどのような意義を持っているのか明らかになっていません。
私たちの研究により、ヘミセルロースの主要成分キシログルカンの再編を担うキシログルカン転移酵素/加水分解酵素(XTH)の欠損が、馴化後の凍結耐性を低下させることを見出しました。さらに、4°Cの馴化(低温馴化)や−3°Cの馴化(氷点下温度馴化)処理によって、ペクチンの側鎖を構成するアラビナンやガラクタンなど、他の細胞壁構造が量的・質的な変化を示すことがわかってきました(図11の緑色部分)。現在は、これらの細胞壁変化が植物の凍結耐性にどのようなメカニズムで影響を及ぼしているのかを明らかにしたいと考えています。
参考文献
- Takahashi et al. (2021) Plant Cell Physiol. (in press) (abstract)
- Takahashi et al. (2021) Plant Cell Environ. 44, 915-930 (abstract)
- Takahashi et al. (2019) Sci. Rep. 9, 2289 (abstract)
- Willick et al. (2018) J. Exp. Bot. 69, 1221-1234 (abstract)
植物の凍結耐性と糖タンパク質
「プロテオグリカンが関わる植物の低温耐性機構」
細胞壁多糖類の構造や細胞壁の機能は様々なタンパク質によって制御されています。また、細胞膜にも同様に細胞壁多糖類の合成や膜表面の性質を制御するタンパク質が存在します。そこで私たちは、凍結耐性に関与する細胞壁関連タンパク質の同定を進めてきました。
中でも、GPIアンカータンパク質と呼ばれる細胞膜脂質に結合したタンパク質の増加が低温馴化で起きていることが示唆されています(低温馴化、図12)。GPIアンカータンパク質は細胞膜表面だけではなく、一部は膜から切り離されて細胞壁にも局在して機能しており、シロイヌナズナでも数百種類あると言われています。その中でも、上記のAGPは植物の代表的なプロテオグリカンであるとともに、主要なGPIアンカータンパク質でもあります(図9)。AGPの一種であるFLAの増加は、シロイヌナズナ植物体だけではなく(図13)、培養細胞やライムギなどでも見られます。私たちは現在、変異体ラインを用いてAGPの欠損が植物に与える影響を解析しています。また、糖鎖分解酵素によりAGPの持つ複雑な糖鎖を分解することで、低温馴化過程によるAGPの糖鎖およびコアタンパク質の変化を明らかにし、AGPの凍結適応機構における意義を探っています。
参考文献
- Li et al. (2020) J. Proteomics 211, 103528 (abstract)
- Miki et al. (2019) J. Proteomics 197, 71-81 (abstract)
- Takahashi et al. (2016) J. Exp. Bot. 67, 5203-5215 (abstract)
- Takahashi et al. (2016) Cryobiology 72, 123-134 (abstract)
- Takahashi et al. (2013) Front. Plant Sci. 4, 90 (abstract)
- Takahashi et al. (2013) Front. Plant Sci. 4, 27 (abstract)
- Takahashi et al. (2013) J. Proteome Res. 12, 4998-5011 (abstract)
- Takahashi et al. (2011) J. Proteome Res. 11, 1654-1665 (abstract)
- Li et al. (2012) Plant Cell Physiol. 53, 543-554 (abstract)