目次
鉄硫黄(Fe-S)タンパク質は、非ヘム鉄と無機硫黄原子から成るFe-Sクラスターを持つタンパク質の総称で、細菌から高等動植物まで150を越える多様な種類が分布し、さまざまな生体反応に関与している。Fe-Sクラスターは一般に、[2Fe-2S] または [3Fe-4S]、[4Fe-4S] の形でタンパク質内部のシステインの硫黄原子に配位し、電子伝達における酸化還元中心として機能する。また、Lewis酸としての触媒機能(dehydratase類)や、ラジカル形成(radical SAM 酵素群)、さらに制御タンパク質(IRPなど)のセンサーとしての機能も広く知られるようになった。これらFe-Sタンパク質の機能を支えているのがFe-Sクラスターの合成系である。
1.はじめに
2.葉緑体におけるATP依存的なFe-Sクラスター形成活性
3.大腸菌ISC(iron-sulfur cluster)マシナリーの同定
4.新たなFe-Sクラスター合成系:SUF(sulfur)マシナリーの同定
5.多様なFe-Sクラスター合成系の特性と微生物の生存戦略
6.ISCマシナリーの構造と機能
7.SUFマシナリーの構造と機能
8.研究の展望と意義
1. はじめに
2. 葉緑体におけるATP依存的なFe–Sクラスター形成活性
Fe-Sクラスターはポリペプチドの翻訳後、タンパク質内部に形成されるコファクターである。 in vitro では Fe2+/3+ と S2- からFe-Sクラスターを簡単に再構成することができるため、従来、Fe-Sクラスターは非酵素的(化学的、自発的)に生じるものと考えられてきた。しかし、この化学的な反応には生理的な濃度をはるかに超える Fe2+ と S2- が必要である。私は1982-1991年、葉緑体におけるFe-Sクラスター形成反応を解析し、システインを硫黄原子の供与体とする、ATP依存的な活性を見出した。すなわち、細胞内ではクラスター形成に酵素的な因子が関与する可能性を初めて示した。しかし、この生化学的なアプローチでは関与する成分の特定に到ることができず、大腸菌を用いた遺伝学的なアプローチに転換した。
3. 大腸菌ISC (iron-sulfur cluster)マシナリーの同定
細胞内には多種多様なFe-Sタンパク質が存在し(大腸菌では全タンパク種の3% 以上)、様々な生理機能を担っているため、Fe-Sクラスター形成に関わる遺伝子のスクリーニングも困難な課題だった (“loss-of-function”型のスクリーニングではどのような表現型が現れてくるか見当もつかない)。そこで、Fe-Sタンパク質の一つ、フェレドキシン(Fd)を大腸菌で過剰に発現させ、細胞内のFe-Sクラスター形成能をホロFdの合成量としてモニターする実験系を構築した。Fe-Sタンパク質は可視部に吸収域をもつため、ホロFdの発現量に対応して大腸菌コロニーの色調が変化する。この系を用いて、共発現させるとホロFdの合成量を大幅に増加させる遺伝子群として、isc オペロン(iscRSUA-hscBA-fdx-iscX)を同定した。Fdポリペプチドの過剰発現下ではFe-Sクラスターの形成過程が律速となるが、同時にiscオペロンを過剰に発現させることによって、この過程が著しく促進されたのである。すなわち、Fe-Sクラスター形成反応に関与する遺伝子群を初めて実験的に捕らえた。また、共発現させるiscオペロン上の8種の遺伝子をそれぞれ個別に不活化することにより、多成分からなる酵素系(ISCマシナリー)として機能することを明らかにした。
この過剰発現系と相補的なアプローチとして、大腸菌ゲノム上のiscRSUA-hscBA-fdx-iscX の8種の遺伝子群をそれぞれ系統的に破壊、またはすべてを欠失させた大腸菌変異体を作成・解析した。それら変異体の多くではsuccinate dehydrogenase や glutamate synthase などFe-Sタンパク質の活性が著しく低下し、それに伴って生育速度の低下、チアミンやニコチン酸などに対する要求性(これらの生合成系路にもFe-Sタンパク質が関与する)が現れた。すなわち、ISCマシナリーは、様々なFe-Sタンパク質のクラスター形成において、重大な役割を担っていることを実証した。さらに、これら変異体の性質を詳細に比較検討し、IscS、IscU、Fdx、HscA、HscB がマシナリーの中心的な成分であることを明確にした。
一方、これら一連の研究の副産物として、応用面での貢献も進んだ。iscオペロンの共発現系は、世界中の研究者から申し込みを受けて供与した。Fe-Sタンパク質の過剰生産に、きわめて有効である。
4. 新たなFe-Sクラスター合成系:SUF (sulfur)マシナリーの同定
iscオペロンの欠失変異体から生じた偽復帰変異体を遺伝学的に解析し、sufABCDSEオペロン(それまで機能未知)の発現量が増加すると、Fe-Sタンパク質群の活性が回復することを見出した。また、sufオペロンの遺伝子群は単独で破壊してもほとんど影響が無いが、iscオペロンとの二重変異は合成致死となった。これらの実験から、sufオペロンにコードされるタンパク質群は、ISCマシナリーと重複した機能を有すると結論した。第二のFe-Sクラスター合成装置(SUFマシナリー)の発見である。ISCとSUFマシナリーの成分を比較すると、SufA/IscA、SufS/IscSはパラロガスな関係にあるが、それ以外の成分の類似性は無い。SUFマシナリーの成分は古細菌、グラム陰性細菌、ラン藻、(葉緑体)など、ISCマシナリーを持たない生物に広く分布しており、Fe-Sクラスター合成系の進化を考える上でも、意義深い発見になった。
5. 多様なFe–Sクラスター合成系の特性と微生物の生存戦略
窒素固定細菌ではNIFマシナリー(nifSUオペロン)がニトロゲナーゼのFe-Sクラスター形成に特異的に機能すると考えられていた。一方、私たちは、ピロリ菌(Helicobacter pylori)や赤痢アメーバ(Entamoeba histolytica、嫌気性の真核生物)といった、窒素固定を行わない微生物のNIFマシナリーに着目した。というのも、これらの微生物には、例外的にISC/SUFに類似の遺伝子群が存在しないからである。遺伝生化学的な解析を進め、これらのnifS、nifUは大腸菌のisc, suf両オペロンと等価な機能、すなわちアポタンパク質に対する特異性の広い、Fe-Sクラスター合成系として機能することを実証した。さらにISC, SUF, NIFについて比較を重ね、それぞれの特性が酸素環境に関連していることを洗い出した。1) NIFマシナリーは酸素存在下では十分機能することができない。窒素固定細菌や一部の嫌気性生物に限定的に分布するNIFは、嫌気的な環境への適応進化と捉えることができる。2) SUFマシナリーは酸素や活性酸素の存在下で最も安定である。この特性は、大腸菌における発現調節機構、さらには酸素発生型の光合成を行うラン藻や葉緑体にSUFが分布することと符合している。
6. ISCマシナリーの構造と機能
1) ISC マシナリーの成分、Fdxの結晶化とX線構造解析(1.7Å分解能)に成功し、[2Fe-2S] クラスター近傍の分子表面に、フリーのシステイン側鎖が位置する新規な構造を明らかにした。
2) IscAタンパク質について生化学的な解析を進め、非常に不安定な [2Fe-2S] クラスターを配位しうることなど、興味深い諸性質を明らかにした。
3) 分子間相互作用について、two-hybrid法とpull-down法を併用した解析を行い、ISCマシナリーの成分間の機能ネットワークの実体を明らかにした。また、IscS-IscU間の硫黄転移反応に関する分子認識機構の詳細を明らかにした。
4) IscS/IscUと相互作用するIscX(別名YfhJまたはORF3、鉄chaperoneと予想)の結晶構造を解明した。ISCマシナリーの反応機構解明のポイントは、中間体 Fe-S クラスター形成の足場、IscUである。
5) 詳細な遺伝学的解析を進め、マシナリーに必須な HscA と HscB の機能が IscU分子内のアミノ酸置換によりバイパスされることを見出した。また、これら変異型のIscU分子11種類の生化学的な解析から、HscA/HscBはIscUの立体構造をdisorderさせる役割があることを明らかにした。
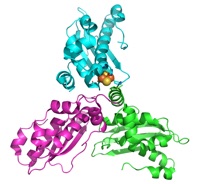
6) 嫌気条件を保つことによって、不安定なFe-Sクラスター中間体を保持したholo型IscUの結晶化に初めて成功した。鉄原子を利用した多波長異常分散法により位相を決定し、非対称な三量体の中に [2Fe-2S] クラスターが一だけ含まれている興味深い構造を決定した。
Fe-Sクラスター合成系は複数のタンパク質から構成される複雑なマシナリーであり、その反応機構を理解するためには、各成分の精製と生化学的な性質の解析、立体構造解析、機能マシナリーとしての分子構築、分子間相互作用の解析、in vitro 反応系の解析、などが必要である。さまざまなアプローチを展開し、これまでに以下の成果をあげている。
Holo-IscUの
結晶構造
7. SUFマシナリーの構造と機能
ISC、SUFともに複雑な反応系である。Fe-Sクラスター合成という一見単純な化学反応に、どうしてこれだけ大掛かりな装置が必要なのだろう? 中間体形成部位の構造とその動的変換のメカニズムを解き明かすことによって、はじめて化学反応としてのFe-Sクラスター形成に結びつけることが可能になり、またクラスターを受け渡すアポタンパク質との相互作用を解き明かすことによって、複雑系としての存在意義を理解することができるようになると考えている。
Fe-Sタンパク質は、エネルギー代謝(光合成、呼吸)や無機物(硫黄、窒素)同化系、ヌクレオチド代謝、アミノ酸代謝、ヘムやクロロフィル、ステロイドホルモン、NADHの合成、DNA修復、環境センサーなど様々な細胞活動において中心的な役割を果たしているため、Fe-Sクラスター形成機構の解明は、細胞機能を統合的に理解する上で欠かせない。また、Fe-Sクラスター合成系を自在に操ることが可能になれば、応用的な発展も期待できる。例えば、ビオチン合成酵素などの不安定なFe-Sクラスターは、産業的にも有望なターゲットである。また、ヒトの遺伝病のいくつか(Friedreich失調症、X染色体連鎖鉄芽球性貧血)については、Fe-Sクラスター合成系との関連性が指摘されている。今後は、これら応用面での貢献も視野に入れて、研究を進めて行きたい。一方、細胞内で鉄イオンの授受を担うと予想される鉄シャペロンについても、これまで多くの候補タンパク質が取りざたされているだけで、憶測の域を出ない。この必須元素の細胞内トラフィックについても新たな突破口を開くべく、準備を進めている。
8. 研究の展望と意義
SUFマシナリーは6種類の成分から構成され、SufS/SufE複合体(硫黄原子の供与体)と、SufA(鉄原子の供与体?)、SufBCD複合体が協調的に機能することで、アポタンパク質にFe-Sクラスターが形成される。SufBCD複合体の具体的な役割は不明だが、これまでの遺伝学的な解析から、マシナリーの中核を担っていることは疑いがない。最近、SufA、SufCそれぞれの結晶構造を決定し、また、SufD二量体、SufC2D2複合体といったサブコンプレックスの結晶構造解析にも成功した。SufCはABC transporterのnucleotide binding domain に類似しており、おそらく、このATPase活性に連動して、SufBCD複合体の構造がダイナミックに変化すると予想している。
Copyright © 1999- Laboratory of Regulatory Network of Cellular Molecules, Saitama University