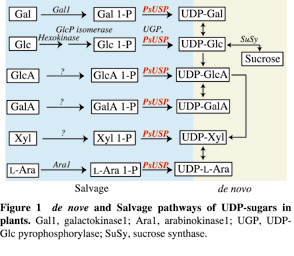
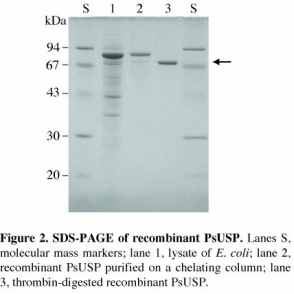
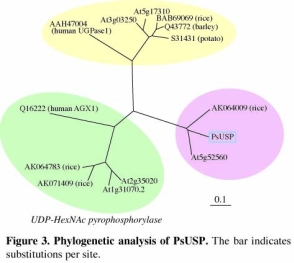
高等植物における糖ヌクレオチドの合成
|
|||
|
|
|||
アラビノガラクタン-プロテインを分解する酵素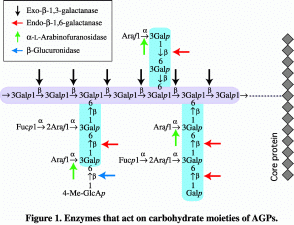
参考文献Konishi et al. (2008) Carbohydr.
Res. 343:
1191-1201 (abstract)
Ichinose et al. (2008) Appl. Environ. Microbiol. 74: 2379-2383 (abstract) Kotake et al. (2006) J. Exp. Bot. 57: 2353-2362 (abstract) Kotake et
al. (2005) Plant Physiol. 138: 1563-1576 (abstract)
Ichinose et al. (2005) J. Biol. Chem. 280: 25820-25829 (abstract) Kotake et
al. (2004) Biochem. J. 377:
749-755 (abstract)
Okemoto et
al. (2003) Carbohydr. Res. 338: 219-230 (abstract)
Kuroyama et
al. (2001) Carbohydr. Res. 333: 27-39 (abstract)
Tsumuraya et al. (1990) J. Biol. Chem.
265: 7207-7215 (abstract)
Hata et
al. (1992) Plant Physiol. 100:
388-396
Sekimata et
al. (1989) Plant Physiol. 90: 567-574
学会ポスター第25回日本糖質学会年会 (2005) (JSCR2005.jpg, 3192 KB)
第24回日本糖質学会年会 (2003) (JSCR2003.jpg, 746 KB)
|
|||
|
|
|||
糖鎖を合成する酵素 (糖転移酵素)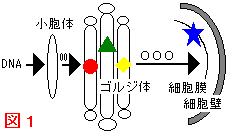
 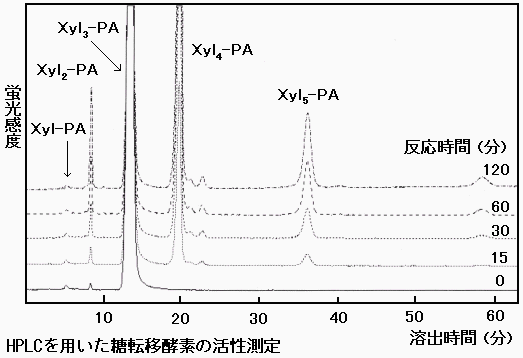 図 3: ピリジルアミノ化 (PA化) したキシロトリオース (Xyl3-PA) に、UDP-キシロースからキシロースが転移され、糖鎖が伸長した産物 (Xyl4-PA、Xyl5-PA) が生じる。 参考文献Kimpara et al. (2008) Ann.
Bot. In press.
Konishi et al. (2007) Planta 226: 571-576 (abstract) Lee et al. (2007) Plant Cell Physiol. 48: 1624-1634 (abstract) Konishi et al. (2004) Planta 218: 833-842 (abstract) Tsuchiya et al. (2005) Physiol. Plant. 125: 181-191 (abstract) Urahara et al. (2004) Physiol. Plant. 122: 169-180 (abstract) |
|||
|
|
|||
糖鎖を分解する酵素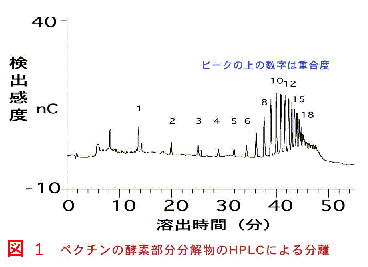
|
|||
|
|
|||
糖鎖の構造
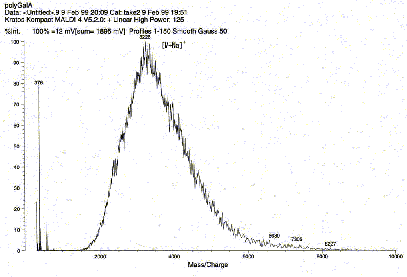 図 1: MALDI-TOF-MSを用いたペクチン断片の分子量測定 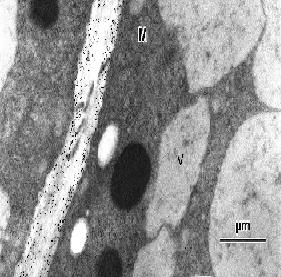 図 2: 抗体を用いて細胞壁糖鎖の局在性を調べた電子顕微鏡写真 小さな黒点 (10 nm) が目的とする糖鎖の局在場所を示す。 参考文献Samaj et
al. (1999) Plant Cell Physiol. 40: 874-883
|
|||