(2)金属ポルフィリン型補因子の金属挿入酵素キラターゼの
触媒機構とその多様性の理解

(2)金属ポルフィリン型補因子の金属挿入酵素キラターゼの
触媒機構とその多様性の理解
(1)Hybrid cluster protein (HCP):の構造と機能、および、
Ni,Fe型CO dehydrogenase(CODH)との進化的関連
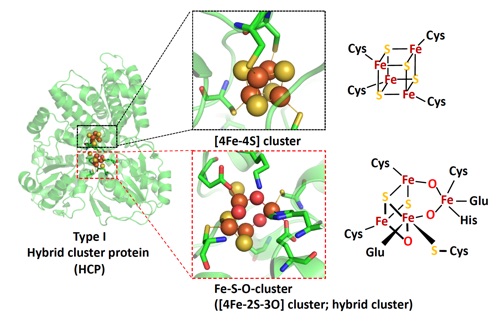
HCPは、Fe-S-O型クラスターをタンパク質中央の活性部位に、[4Fe-4S]クラスターをN末端部位にもつ金属酵素であり、ヒドロキシルアミン還元酵素およびNO還元酵素活性があることが知られています。HCPは、その構造分類上、Class I, II, IIIの3種類が知られていますが、1980年代後半にDesulfovibrio属由来のclass IのHCPの構造以外は、長らく不明とされてきました。これまでに我々のグループでは、class IIや IIIのHCPの構造解析や生化学的、分光学的解析を行い、HCPのtype間での共通点や相違点を明らかにし、HCPや、その類縁酵素であるCO dehydrogenase (CODH)の分子進化の道筋を示しました。
現在は、HCPとCODHの間で人工的に分子進化を起こせるのか、さらには両者の共通祖先のような酵素や活性発現に必要な構造要素は存在するのかなど、酵素立体構造と機能の解析から、起源的な生物の利用するHCP/CODH superfamilyの分子進化について、さらに詳細な検討を進めています。
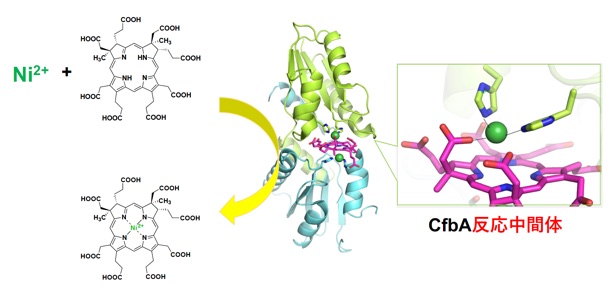
ヘムやビタミンB12などの「金属ポルフィリン錯体型」の無機補因子は、生物の様々な代謝反応に必須であり、その生合成機構は古くから興味を持たれてきました。特に、金属イオンをポルフィリンに挿入するキラターゼ酵素群は、生合成される金属ポルフィリンの種類に応じた基質選択性(金属イオンやポルフィリン選択性)があるとされています。キラターゼ酵素もまた、構造と機能の違いでclass I, II, IIIと分類されており、我々のグループは最も多くの種類が知られるclass II キラターゼの祖先型、CfbAの構造-機能相関の解明を実施しました。
CfbAはキラターゼの中で唯一ニッケルイオンを生理的な基質として利用する特徴を有しており、他のキラターゼと比較しながら、class IIキラターゼの金属イオン選択性の違いを生み出す要因の解明を進めています。また、様々な生物のゲノム情報をもとに、新規のキラターゼの探索とその構造、機能解析を行い、生物がいかにして 金属ポルフィリン錯体を補因子とするようになったかについての理解も進めています。
Copyright © 1999-2026 Laboratory for Bio-elemental Chemistry, Saitama University.
(3)重元素や三重結合などユニークな構造を持つアミノ酸代謝酵素の探索と仕組み、その活用法
アミノ酸は生物にとっての必須構成要素であり、また産業においても重要な生体物質と言えます。私たちは、アミノ酸の中でも生物にユニークな性質をもたらす硫黄やセレンなどの”カルコゲン”元素含有アミノ酸や金属イオンによって活性化する三重結合を持つアミノ酸の代謝系の酵素の探索と、それら酵素の構造-機能相関解析を進めています。
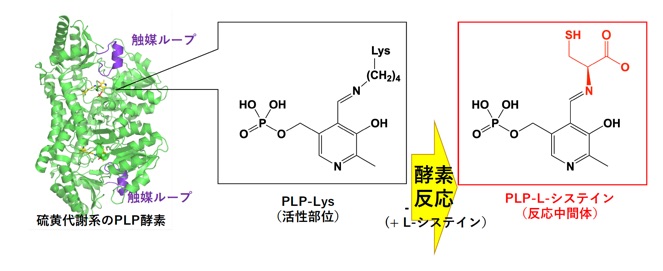
例えば、ピリドキサール-5’-リン酸(PLP)を活性部位とするPLP依存型酵素の1つ、硫黄代謝に関わるシステイン脱硫黄酵素SufS、IscS、NifSの触媒機構や阻害剤の探索、分子進化についての研究を進めています。また、部位特異的変異や指向性分子進化法を用いて、重元素含有アミノ酸や3重結合含有アミノ酸などのユニークなアミノ酸の合成を行うための酵素触媒系の開発も行っています。