山口研究グループの主な研究内容
植物転写因子の分子機能の解明
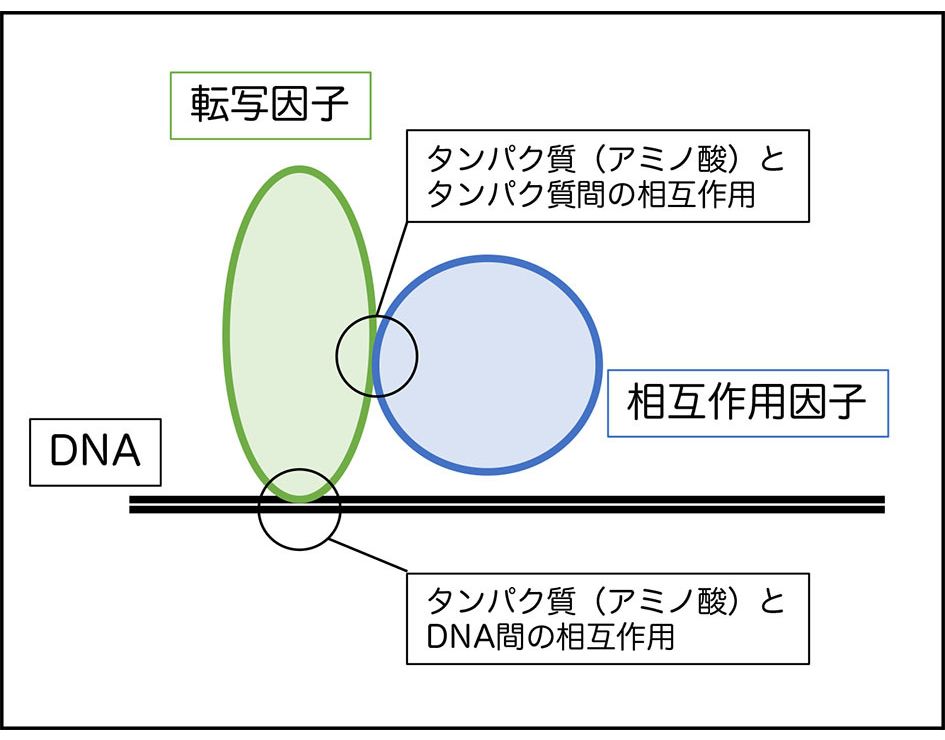
生命活動は、タンパク質やDNA、代謝産物など、様々な生体分子による分子間相互作用の総体で成立すると考えられます。その中で私は、主に植物の転写因子に着目して研究を行なっています。
転写因子は、特定のDNA配列に結合することで、遺伝子の転写を制御しています。アミノ酸配列が非常に似た転写因子でも、DNAの結合配列特性にわずかな差が生じ、その結果異なる分子機能を獲得する例が多く知られています。また、多くの転写因子は他のタンパク質と複合体を形成することで、その機能が活性化、もしくは抑制されることも知られています。私は、植物の転写因子について、タンパク質-タンパク質間、およびタンパク質-DNA間といった分子間相互作用に必要なアミノ酸残基やDNAのコンセンサス塩基配列を特定することを目指しています。
二次細胞壁形成を制御する転写因子
 葉の暗視野像。通常白く観察される道管はつながっているのに対し、VNI2が過剰発現した植物体では、断続的な道管が観察されます。
葉の暗視野像。通常白く観察される道管はつながっているのに対し、VNI2が過剰発現した植物体では、断続的な道管が観察されます。
植物細胞は、細胞膜の外側に細胞壁を形成します。また、地上で最大のバイオマスである樹木の材の大部分を占める維管束木部を構成する細胞など一部の細胞では、より肥厚した二次細胞壁を形成します。細胞壁は主にセルロースやセミセルロースなどの多糖やリグニンなどにより構成されており、近年持続的で再生可能なバイオマスとして期待されています。山口が理化学研究所在籍時に所属していた出村拓研究チームでは、NACドメイン転写因子であるVND6、およびVND7が道管細胞を作り出す鍵因子として機能することを明らかにしました(Kubo et al. 2005 Genes Dev.)。また、直接結合することでVNDタンパク質の働きを抑える別のNACドメイン転写因子VNI2を同定しました(Yamaguchi et al. 2010 Plant Cell)。
環境ストレス応答機構におけるVNI2の役割
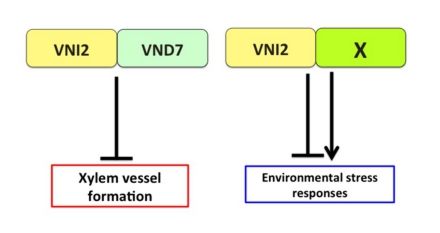 道管形成においてVNI2はVND7と結合し、VND7の働きを抑えています。一方、環境ストレス応答においては他の転写因子と結合し、その機能を制御していると私たちは作業仮説を立てて研究を行っています。
道管形成においてVNI2はVND7と結合し、VND7の働きを抑えています。一方、環境ストレス応答においては他の転写因子と結合し、その機能を制御していると私たちは作業仮説を立てて研究を行っています。
VNI2は、環境ストレス応答や老化に関わることが報告されています。私たちは、VNI2と相互作用する因子を探索したところ、数多くの転写因子を単離しました。これらの中には、ストレス応答に関わることが知られるNACドメイン転写因子が含まれていました。これらのNACドメイン転写因子の作用機構を明らかにすることで、VNI2の環境ストレス応答における分子機能を明らかにしようと試みています。
![]()
VNI2のタンパク質分解機構
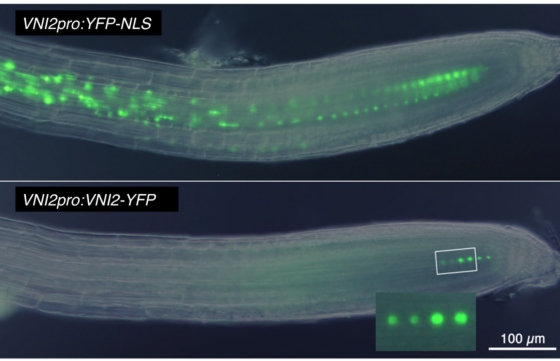 YFPタンパク質の蛍光シグナルはVNI2と融合させることで著しく減少していることが分かります。
YFPタンパク質の蛍光シグナルはVNI2と融合させることで著しく減少していることが分かります。
転写抑制因子であるVNI2は上の図の通り、著しく不安定なタンパク質です。VNI2のC末端領域にはタンパク質分解の標的配列として知られるPESTモチーフがありますが、このPESTモチーフを欠失すると、VNI2タンパク質の安定性は高まり、その結果VND7に対する転写阻害効果が強まります(Yamaguchi et al. 2010 Plant Cell)。しかし、どのような分子機構でVNI2のタンパク質分解が制御されているかは不明でした。私たちはVNI2と相互作用する因子を探索したところ、ユビキチンE3ライゲース複合体の構成因子の一つを単離しました。ユビキチンE3ライゲースとは、標的タンパク質にユビキチンタンパク質を修飾することで、分解を促す働きを持っています。この相互作用因子がVNI2のタンパク質の安定性を制御しているか解析を行っています。現在までに、この相互作用因子はVNI2のPESTモチーフに結合することを明らかにしています。
異常な二次細胞壁を形成するイネカマイラズ変異体
 通常の植物(日本晴、上)と比べてカマイラズ変異体(bc4変異体、下)は軽く折り曲げるだけで簡単にちぎれてしまいます。
通常の植物(日本晴、上)と比べてカマイラズ変異体(bc4変異体、下)は軽く折り曲げるだけで簡単にちぎれてしまいます。
二次細胞壁形成に異常がある植物は物理的強度が大きく変化します。イネカマイラズ変異体は文字通り、鎌が必要ないくらい簡単に茎がちぎれます。これらの原因遺伝子を突き止め、その役割を解析することは、二次細胞壁形成機構の解明や、物理的強度を改変した有用植物の作出などに役立つことが期待されます。現在までにイネから15種類程のイネカマイラズ変異体が報告されていますが、それらの中にはまだ原因遺伝子が見つかっていない変異体があります。私たちはこのようなカマイラズ変異体の原因遺伝子の特定を進めています。

 ホーム
ホーム 研究内容
研究内容 メンバー紹介
メンバー紹介 研究業績
研究業績 研究室情報
研究室情報 Home in English
Home in English Research in English
Research in English Member in English
Member in English Publications in English
Publications in English News in English
News in English