研究内容
多糖類をよりよいものに改良する
「マンナン多糖類の構造多様性とその改良」
植物細胞壁のマンナン多糖類は、主鎖がβ-1,4-結合したマンノースやグルコースから成る多糖類の総称で、緑藻と陸上植物に見られます。マンナン多糖類の主鎖は、グルコースとマンノースがランダムに並ぶもの(例:コンニャクグルコマンナン)や、マンノースのみで構成されるもの(例:象牙ヤシホモマンナン)、グルコースとマンノースが交互に並ぶもの(例:シロイヌナズナβ-ガラクトグルコマンナン)などがあり、構造が多様です。側鎖が付くこともありますが、その側鎖もガラクトース1つのもの、2つのもの、付かないものがあります。さらに、アロエのアセマンナンのように多数のアセチル基が付くものもあります。これらの構造多様性は、象牙ヤシのようなカチカチな性質や、増粘剤のようなドロドロな性質、コンニャクのようなゲルになる性質を生んでおり、幅広い用途につながっています。マンナン多糖類の合成を改良・制御することができれば、さらに付加価値を高め、用途を広げることが可能です。
マンナン多糖類の合成は、基本的に以下の3ステップで進みます。まず(i)主鎖の原料である糖ヌクレオチド(GDP-マンノースやGDP-グルコース)が細胞質基質で合成され(Sawake et al., 2015)、続いて(ii)ゴルジ体で糖ヌクレオチドから主鎖が合成され、(iii)側鎖ガラクトースやアセチル基が付加されます。これら(i)、(ii)、(iii)はグルコマンナンの合成量や糖鎖構造を決めており、性質(溶けやすさ、粘性、セルロース結合性など)や価値、用途に影響します。最近、グルコマンナンの主鎖構造は、CslAという合成酵素の分子種によって決まることがわかってきました(Nishigaki et al., 2021; Yoshida et al., 2023)。また、海外との共同研究では、ガラクトース側鎖の付加パターンが主鎖構造によって決まる(ガラクトース付加酵素は主鎖構造を認識して付加する)こともわかりました(Yoshimi et al., 2025)。したがって、個々のCslA分子種がどのような主鎖を作るのかを解明することが重要です。
私たちの研究室では、モデル植物のシロイヌナズナに異種植物のCslAなどのマンナン多糖類合成関連遺伝子を導入して糖鎖構造を改良する、といった研究を進めています。また、いくつかの植物で可溶性のグルコマンナンが高蓄積する仕組みも探っています。
参考文献
- Nishigaki et al. (2021) Physiol. Plant. 173, 1244-1252 (Abstract)
- Sawake et al. (2015) Plant Cell 27, 3397-3409 (Abstract)
共同研究
- Yoshimi et al. (2025) Nat. Commun. 16, 1235 (Abstract)
- Yoshida et al. (2023) Mol. Plant 16, 1460-1477 (Abstract)
- Yu et al. (2018) Plant Physiol. 178, 1011-1026 (Abstract)

様々な糖はどのように作られるのだろうか?
「植物の糖ヌクレオチド合成経路の同定・改良」
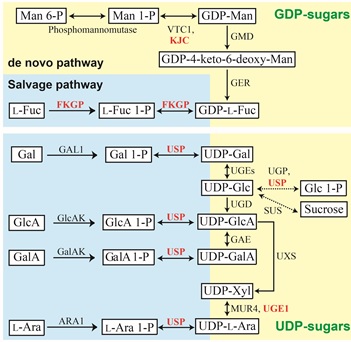
光合成で同化された炭素の大半は、糖ヌクレオチドを経て、植物の細胞壁の多糖類として蓄積します(図1)。糖ヌクレオチドはその名の通り、グルコース(Glc)などの単糖とUDPなどのヌクレオチドが結合した物質です(図2)。したがって、糖ヌクレオチドの合成量は同化炭素の多糖類への変換に影響します。
糖ヌクレオチドの合成経路にはde novo経路(新生経路)とsalvage経路(再利用経路)の2種類があり、新生経路では、UDP-Glcを初発基質とした変換反応により様々なUDP-糖が合成されます。新生経路は、Glcから他の糖を生む経路でもあり、この経路が植物の構成糖を決めています。例えば、L-アラビノース(L-Ara)やガラクツロン酸(GalA)は植物に特有の糖ですが、これは植物がUDP-L-AraやUDP-GalAを作る経路を持っているためです(Kotake et al., 2016, J. Plant Res.)。一方、再利用経路は、多糖類の分解などで生じた単糖を単糖1-リン酸を経て糖ヌクレオチドに変換する、リサイクル経路です(図3)。
私たちはエンドウ芽生え (トウミョウ) 中に、糖1-リン酸をUDP-糖に変換する新規な酵素、UDP-糖ピロフォスフォリラーゼ、USPを発見し、生化学的に精製するとともに、遺伝子を単離することに成功しました(Kotake et al., 2004, J. Biol. Chem.)。USPは糖 1-リン酸に幅広い基質特異性を持った酵素で、様々な糖1-リン酸をUDP-Glc, UDP-Gal, UDP-GlcA, UDP-Xyl, UDP-L-Ara に変換する活性を持っています。大腸菌で作成した組換えUSPタンパク質も同様の活性を持っていました。この酵素は新種の酵素だったので、国際生化学・分子生物学連合の酵素命名委員会に報告し、酵素番号(EC 2.7.7.64)が付与されました。
他にも、L-フコースからL-フコース1-リン酸、L-フコース1-リン酸からGDP-L-フコースの2段階の変換を1つのタンパク質で行うFKGPや、細胞質基質でUDP-L-アラビノースを合成するUGE1、GDP-マンノース合成に関わるKONJACタンパク質を発見・同定しました(図3中で赤字の酵素)。現在は、植物は「いつ、どのようにL-AraやGalAの合成系を獲得したのか」という疑問に取り組んでいます(Umezawa et al., 2024, Plant J.)。また、糖ヌクレオチドの代謝経路を改良することで、私たちにとって有用な多糖類を高生産・蓄積する植物の開発にも取り組んでいます。
参考文献
- Umezawa et al. (2024) Plant J. 118, 508-524 (Abstract)
- Kotake et al. (2016) J. Plant Res. 424, 169-177 (Abstract)
- Sawake et al. (2015) Plant Cell 27, 3397-3409 (Abstract)
- Kotake et al. (2009) Biochem. J. 129, 781-792 (Abstract)
- Kotake et al. (2008) J. Biol. Chem. 283, 8125-8135 (Abstract)
- Kotake et al. (2007) Biosci. Biotechnol. Biochem. 71, 761-771 (Abstract)
- Kotake et al. (2004) J. Biol. Chem. 279, 45728-45736 (Abstract)
新種の分解酵素の探索と利用
「植物のプロテオグリカンの糖鎖を分解する酵素」
多糖類を分解する酵素には200種類ほどが知られていますが、そのうちの3種類は、私たち「埼玉大」が発見したアラビノガラクタン-プロテイン (AGP) の糖鎖の分解酵素です。
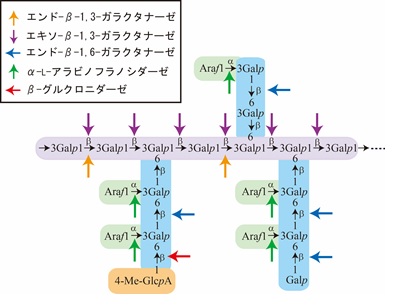
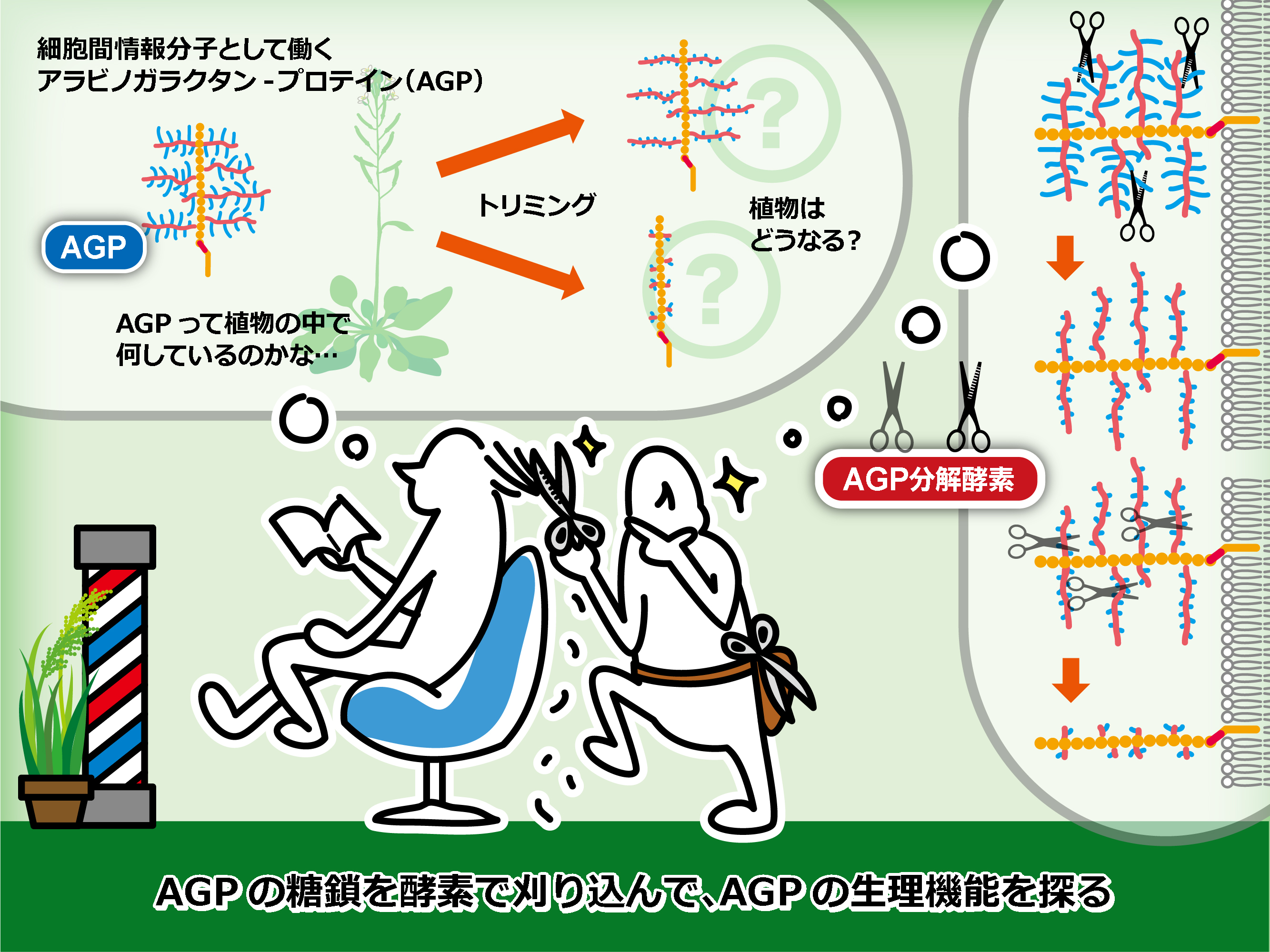
AGPは植物の原形質膜や細胞壁に存在する糖鎖の大きい糖タンパク質であり、「植物のプロテオグリカン」と呼ばれることもあります(図4、生きた植物でAGPをGFPで可視化した写真)。AGPは陸上植物に普遍的に見られる細胞外成分で、阻害剤であるYariv試薬を用いた実験から、細胞分裂、細胞生長、細胞接着、細胞死などに関わることが明らかになっていますが、未だに分子機能はわかっていません。AGPの糖鎖は重量の90%以上を占めており、糖鎖の主鎖はβ-1,3-ガラクタン、側鎖はβ-1,6-ガラクタンです。側鎖にはさらに、L-アラビノースやグルクロン酸、4-メチルグルクロン酸、L-フコースなどが結合しています(図5)。AGPには多数の分子種があるため、変異体を用いた機能解析が困難です。また糖鎖が複雑であることも機能解析を難しくしています。
私たちは、AGPの糖鎖が共通してβ-1,3-ガラクタン主鎖とβ-1,6-ガラクタン側鎖を持つことに着目して、植物を糧としているカビやキノコから、新種の分解酵素の探索を進めてきており、これまでに、エキソ-β-1,3-ガラクタナーゼ (EC 3.2.1.145)、エンド-β-1,3-ガラクタナーゼ (EC 3.2.1.181)、エンド-β-1,6-ガラクタナーゼ(EC 3.2.1.164)を発見しました。また、β-ガラクトシダーゼ、α-L- アラビノフラノシダーゼ、β-L- アラビノピラノシダーゼ、β-グルクロニダーゼを同定しました (図5)。
現在は、これらのカビやキノコの分解酵素遺伝子を植物に遺伝子導入する実験を進めており、「植物生体内でAGPの機能を攪乱すると何が起こるのか」を調べています(図6)。
参考文献
- Ghosh et al. (2023) Carbohydr. Res. 528, 108828 (Abstract)
- Kikuchi et al. (2022) Front. Plant Sci. 13, 1010492 (Abstract)
- Ito et al. (2020) Plant Biotechnol. 37, 459-463 (Abstract)
- Yoshimi et al. (2020) J. Exp. Bot. 71, 5414-5424 (Abstract)
- Imaizumi et al. (2017) J. Exp. Bot. 68, 4651-4661 (Abstract)
- Yoshimi et al. (2017) Carbohydr. Res. 453-454, 26-35 (Abstract)
- Kitazawa et al. (2013) Plant Physiol. 161, 1117-1126 (Abstract)
- Kotake et al. (2011) J. Biol. Chem. 286, 27848-27854 (Abstract)
- Konishi et al. (2008) Carbohydr. Res. 343, 1191-1201 (Abstract)
- Kotake et al. (2006) J. Exp. Bot. 57, 2353-2362 (Abstract)
- Kotake et al. (2005) Plant Physiol. 138, 1563-1576 (Abstract)
- Kotake et al. (2004) Biochem. J. 377, 749-755 (Abstract)
共同研究
- Ichinose et al. (2008) Appl. Environ. Microbiol. 74, 2379-2383 (Abstract)
- Ichinose et al. (2005) J. Biol. Chem. 280, 25820-25829 (Abstract)
ポキポキ折れるイネ
「イネのカマイラズ変異体の原因遺伝子クローニングと機能解析」
細胞壁には、成長中の細胞にみられる一次細胞壁と、成長が終わった細胞で一次細胞壁の内側に肥厚する二次細胞壁の2種類があります。樹木の幹は大半が二次細胞壁でできています。また、イネやコムギの葉や茎も二次細胞壁を肥厚させて堅くなります。イネのカマイラズ変異体はその名(鎌要らず)のとおり、軽く折り曲げただけで割れたりちぎれてしまう、二次細胞壁が異常な突然変異体です(図7)。カマイラズは、イネだけでも、原因遺伝子の異なる10種類以上知られていて、英語でbrittle culm(bc、脆い茎)1~15という名前がついています。
私たちは、このうちのbc3とbc4、bc6の原因遺伝子を突き止めることができました。多くのカマイラズでは、二次細胞壁の主成分であるセルロースを正常に合成できないために、普通のイネ(図8左)と比べて細胞壁が薄くなっています(図8右)。カマイラズの原因遺伝子は様々で、例えばbc6ではセルロース合成酵素に異常があり、bc3では細胞内の膜輸送に関わる因子に異常があります。カマイラズの原因遺伝子の機能解析を通して、植物の二次細胞壁の合成メカニズムを明らかにしたいと考えています。
参考文献
- Yamaguchi et al. (2025) Plant Cell Physiol. 66, 1444-1453 (Abstract)
- Kotake et al. (2011) J. Exp. Bot. 62, 2053-2062 (Abstract)
- Hirano et al. (2008) Planta 232, 95-108 (Abstract)
- Aohara et al. (2009) Plant Cell Physiol. 50, 1886-1897 (Abstract)
共同研究
- Miyagi et al. (2022) Metabolomics 18, 95 (Abstract)
- Hirano et al. (2017) Planta 246, 61-74 (Abstract)